作用機序
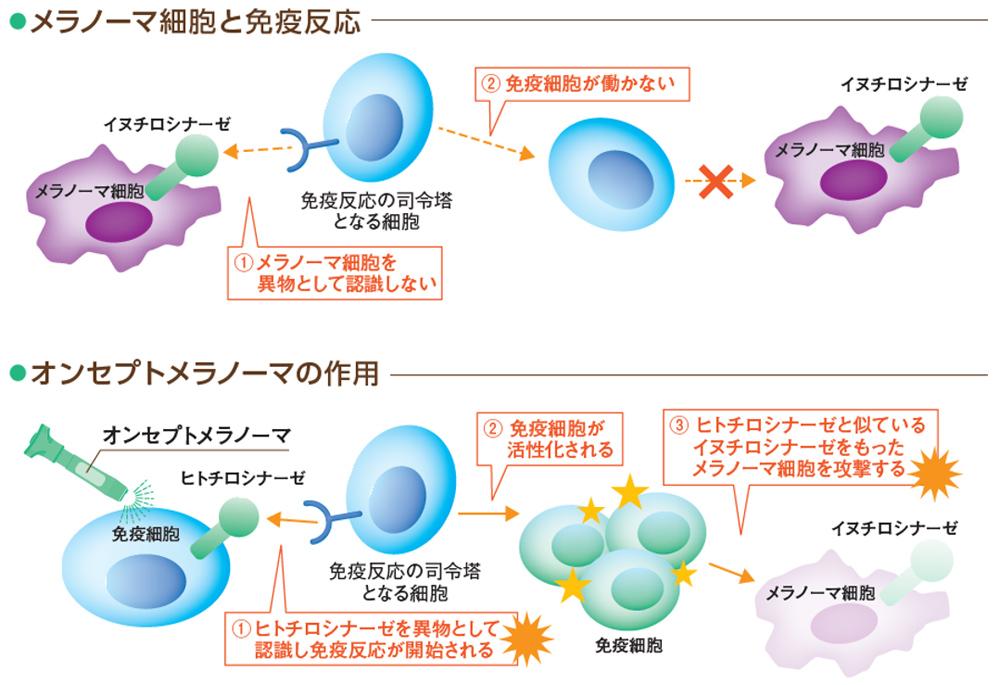
- オンセプト® メラノーマはヒトの皮膚メラノサイト表面に発現する、ヒトチロシナーゼの遺伝子配列をコードするプラスミドDNAを使用して生成されています。
- イヌチロシナーゼは、正常な犬の皮膚メラノサイト表面に発現するタンパク質で、メラノーマでは大量に発現しますが、それ自体は犬の体内では異物として認識されません。
- オンセプト® メラノーマを犬に投与すると、プラスミドDNAが宿主細胞に取り込まれ、ヒトチロシナーゼタンパク質が宿主細胞内で転写されます。ヒトチロシナーゼタンパク質は犬の体内では異物として認識されて免疫細胞に発現し、免疫応答を誘導します。
- ヒトチロシナーゼはイヌチロシナーゼと相同性があるため、ヒトチロシナーゼに対する免疫応答の交差反応によって、腫瘍性メラノサイトを排除します。
米国および国内臨床試験概要
被験薬群:腫瘍原発巣の外科的切除(必要な場合は所属リンパ節の外科的摘出)を実施したステージII又はステージIIIの口腔内メラノーマの犬に対して初回免疫として約2週間隔で4回、その後補強免疫として6ヵ月間隔でオンセプト® メラノーマを投与
対照群*:無投与対照群(既存データ)
生存期間:腫瘍原発巣の外科的切除からメラノーマに起因した死亡までの日数
*:国内臨床試験においては当初の試験計画書に基づくレトロスペクティブのデータ(国内での最近10年間の症例)での評価可能症例が3症例のみであったため、途中でMacEwenのデータに変更した。
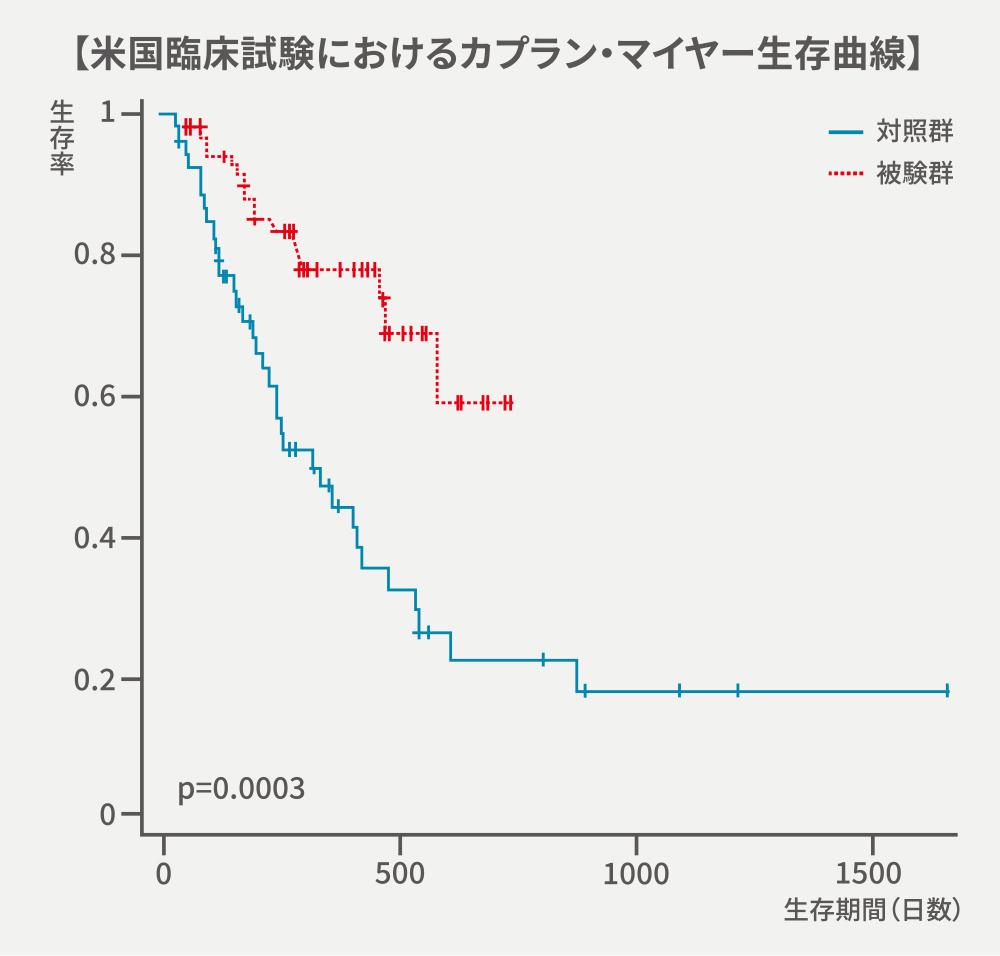
米国臨床試験の結果
被験群(53頭)は対照群(53頭)と比較して生存期間の有意な延長がみられた(p<0.0003)
異常な事象の件数の報告も少なく、報告された事象も軽度又は中等度であった
参考:オンセプト® メラノーマ製造販売承認申請資料
米国及び国内臨床試験においてWHOガイドラインに基づく犬における口腔内メラノーマの腫瘍ステージII又はIIIに対する本剤投与は、高い安全性とともに、有効である又は有効性を示す可能性があると考えられました。
なお、国内臨床試験においては被験薬の有効性を実証するために十分な症例数を確保できていなかったことから、オンセプト®メラノーマは日本国内においては条件付き承認となっており、製造販売後臨床試験を実施することとなっています。
